|
| アイソレータ式
げっ歯類 ケージ・システム
(技術状況) 論 説
過去15年によって、研究に用いられるげっ歯類の収容方式に顕著な変化がもたらされた。これらの変化は遺伝子操作マウスの使用の著しい増加と時を同じくしており、また、ほとんどは、この増加が駆動力となっていた。注目すべき変化には、アイソレータ・ケージの日常的な使用があり、つい最近では、個別換気式アイソレータケージ・システムへの移行がある。新しい装置の多くにはかなりの利点があるが、それらは非常に大きな資本投下が必要である。重要なことは、ユーザはいろいろなケージ・システムの運転上の違いを認識してから特定の用途に適したものを選択しなければならないということである。この総説では、歴史的展望、装置の評価に関する数少ない実験データの論評、市販の換気式ケージ・システム(VCS)のデザインと性能、および予定される用途に基づいた選択基準の総説を行うつもりである。読者は、アイソレータ式ケージ・システムのデザインに関して大幅な変化が引き続き行われていること、いろいろな装置が提供されていること、それらを製造しているメーカがたくさんあることを、認識しておかなければならない。
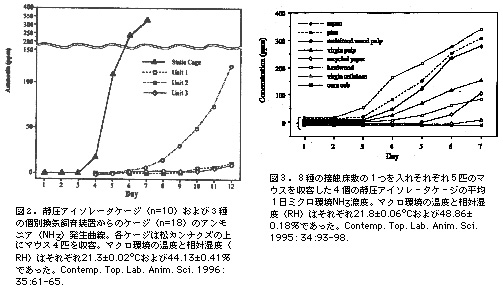
今日、げっ歯類を使用している研究所の多くはそれらの動物を外来性病原体からフリーに入手し維持することができるけれども、この変化は最近になってからである。業者が望ましくない病原体フリーのげっ歯類を供給し、研究所がそれらげっ歯類を望ましい“クリーン”な状態に維持することができるようになったのは、やっとここ20年来のことである。研究所が“クリーン”なげっ歯類を、とくに汚染されたげっ歯類とクリーンなげっ歯類を同時に収容し使用するときに、維持することができるのは、一部には、最新の静圧アイソレータケージ・システムの設置と使用によるものだということができる。 1950年代終わりにLisbeth Kraftによって開発された最初のアイソレータ・ケージ(1)は入ってくる空気を濾過するファイバーグラスで包まれた金属メッシュのサイドを持つ亜鉛メッキ・ソリッド底とぴったり合う上フタから作られた円筒ケージであった(図1)。ケージ、床敷、飼料および飲水は蒸気滅菌し、生物学的安全キャビネットの前身である細菌学的継代フードの中でのみ取り扱う。この装置を用いて、Dr. Kraftは、および、その後、他の研究者達は、類似の装置を用いて、免疫的に未熟なマウスが乳仔マウスの流行性下痢すなわち非常に感染性の高いロタウイルスに汚染するのを予防することができた(1-4)。 Dr. Kraftの成功に動機づけられて、その後いろいろなフィルター・フタのデザインの開発が見られた。フタには、ワイヤ製保持器の代わりに取り付けられた成形ファイバーグラス・メディア、微細ワイヤ・メッシュおよび成形ポリエステルがある。これらのフタの多くは、外れやすくなる、洗浄や滅菌中にゆがみが生じる、ケージ内換気が悪くなるなどの欠点をもっている。 最新のフィルタートップは、Robert Sedlacekの発明品である。彼はMassachusetts General Hospital (MGH) で放射線生物学研究に用いられていたノトバイオート・マウスの大コロニーの監視に責任を持っていた。彼らのノトバイオート・コロニーをアイソレータ内で維持することの経済的関心が駆動力となって、Mr. SedlacekおよびMGHの彼の同僚達は、今日、合衆国で広く使用されている静圧アイソレータケージ・システムを開発した。Sedlacek式ケージは静圧アイソレータ・トップ・ケージのデザインを顕著に改善した。トップは、穴あきアルミニウム・プレートによって保持されている1片のポリエステル・フィルター・メディアを装着したポリカーボネート・フレームからできている(5)。フィルタートップの底にある縁は、そこで下のケージの上にフィットしており、ペトリ皿に見られるのに似た接合を作り出す縁を形成していた。この装置が成功したもう1つの構成物は水平流クラス100マスエア換気ユニット(MADU)の同時使用である。この中でマウスおよび、蒸気滅菌したケージ、フィルタートップ、床敷そして飼料の取扱が行われる。この装置は、適切に使用すれば、病原体フリーで免疫不全のげっ歯類などの動物を維持するのに極めて効果的なツールであった。 最近、Sedlacek式フィルタートップは2つの形態で合衆国の数社によって製造されている:標準トップと縁の高さを低くしたものである。後者は積み上げ密度が非常に高くなる。ポリカーボネート・グリッドの代わりに用いられるようになったアルミニウム・プレートはReemayィファブリックから通常作られているフィルターを保持するようになっている。Reemayィファブリックは1枚の連続のランダムに並べられたフィラメント・ポリエステル線維に作られたスパンボンデッドのポリエステルであり、フィルタートップに用いられる基本的メディアである。Reemayィフィルターにはいろいろな厚さのものがあり、低いデニールのものとレギュラーのデニールのものがあり、粒子の捕捉能に差がある。Reemayィ 2033, 2024,および2295はもっとも一般に使用されているフィルタートップのグレードである。ファブリックが空気を通す能力は粒子の捕捉能に反比例する。静圧アイソレータケージ・システムは、水平または垂直クラス100 MADUと一緒に使えば製品(動物)を保護することができ、生物学的安全キャビネット(BSC)および適切なテクニックと一緒に使えば製品と職員を保護することができる。フィルタートップはケージ内のアレルゲン性タンパクも捕捉し、マクロ環境内の濃度を減らす(6)。アレルギーは動物取扱者に影響する最も重要な職業病の1つであるので、この利点は大きい(7)。 Sedlacek式静圧アイソレータケージ・システムが市場に出てから間もなく、ユーザ、とくに夏の間に除湿が難しい温帯地方のユーザは、この装置の重大な限界に気づくようになった。フィルタートップのデザインは、動物を保護したり、汚染物をケージ内に封じ込めるのに極めて効果的であるが、動物が暴露されているミクロ環境と、換気されて厳密にコントロールされているマクロ環境との間の換気を実質的に阻害する。以前のフィルタートップのデザインにも類似の問題があったが、Sedlacek式デザインの結果として、換気に大きなインピーダンスがかかり、その結果としてミクロ環境の空気の品質にかなりの問題が起きている(8-12)。ケージのミクロ環境と動物室との間のほとんどの換気が、期待と異なりフィルターメディアを介してではなく、ケージとフタとのインターフェースにおいて行われるので、フタが実質的に換気を阻害する(13)。フタの表面に暴露しているフィルターメディアの量はケージ内換気に関して全くあるいは最小限の役割しか演じなかった(12)。フィルタートップは水分交換の実質的なバリアである(9, 12, 14-16)。ケージ内相対湿度(RH)はマクロ環境のRHに比べて38%も増加することがあり、この差は低いマクロ環境RHに収容するときにさらに顕著になる(15-17)。ミクロ環境のRHは収容密度とともに増大する(15, 16)。ミクロ環境のRHの増加から生まれる主な関心事はケージ内アンモニア(NH3)濃度に及ぼすインパクトである。ミクロ環境のNH3濃度は、the Guideに規定されている最大数のマウスを収容するとき、用いる床敷およびマクロ環境のRH次第によっては7日以内に350 ppmに達することもある。この濃度は、作業場における人の暴露に対してAmerican Conference of Governmental Industrial Hygienists (ACGIH) が設定した限界値(25 ppm 8時間加重平均[TWA])を14倍も超えている(20)。生理学的変化および研究との干渉が静圧アイソレータ・ケージ内で観察される濃度で予測される(21-31)。さらに、NH3は粘膜の強力な刺激物であるので、人道的関心が高まってきた(32)。面白いことに、Bob Sedlacekおよびその同僚達は、この問題に直面しなかった。なぜならば、彼らが装置を開発したノトバイオート・コロニーはウレアーゼ産生菌がフリーだったからである。ウレアーゼ産生菌は糞尿中の尿素をNH3に変換する。彼らはまた熱不安定性の尿素分解酵素およびウレアーゼ活性化酵素を含むかもしれない接触床敷をオートクレーブしていた(33)。 NH3に加えて、二酸化炭素(CO2)の濃度も静圧アイソレータ・ケージにおいて有意に増加する(10, 12, 34)。濃度は最大許容バイオマス以上に収容するとき、マクロ環境で観察されるよりも4,000 ppmも高くなることがある(35)。しかし、静圧アイソレータで観察される最大CO2濃度はヒトに対してACGIHによって設定された暴露限界(3,000 ppm 8-h TWA)を越えない(20)。それゆえに、その増加にほとんど関心がおかれなかった。しかし、特定の研究にインパクトを与える生理学的変化の可能性がある。 静圧アイソレータにおけるこのほかのミクロ環境の汚染物に関する研究は少ない。各種の接触床敷を入れた静圧アイソレータにおけるミクロ環境の評価は水素ガス、2-ブタノール、アセトン。エタノール、一酸化炭素、酢酸、硫化水素、二酸化硫黄、ホルムアルデヒド、および揮発性アルコールとケトン類、すべて細菌の酵素活性の潜在的産物について行われた(35)。酢酸(0.86 ppm)および二酸化硫黄(0.42 ppm)の濃度の増加だけがオートクレーブしたコーンコブ床敷を入れたケージで検出された。両化合物は、それぞれ10 ppmおよび2 ppmのACGIH 8-h TWA以下の濃度で検出された(20)。しかし、酢酸濃度は0.5 ppmのNIOSHユs TWAを越えた(36)。酢酸は、おそらくマウスに伴う細菌からの産物というよりもむしろ、コーンコブに伴う植物性原料の分解によって発生するのであろう。他の研究において、メタンと硫化水素の濃度が静圧アイソレータで調べられた(34)。7日後にメタンが > 500 ppmの濃度で観察された:しかし、硫化水素濃度の増加は認められなかった。これらの所見の生理学的関連および研究に及ぼす影響は明かでない。特性の分からない汚染物がアイソレータケージ内に存在するという実験結果がある。ラットにおける臭化メチルの吸入毒性に関する試験によって、観察された高いNH3濃度あるいは臭化メチルに起因することができない嗅覚細胞の減少が明かとなった(37)。しかし、NH3および硫化水素だけの存在が調べられた。 Baerら(38)は最近、1週間、静圧アイソレータに収容したマウスの成長率が、フタのないケージに収容したときの成長率よりも大きいことを観察した。飼料および飲水の摂取量は影響を受けなかったので、著者達はその差は、マウスを静圧アイソレータのより暖かくて高い湿度のミクロ環境に収容したとき、動物の活動が減少したというような単純な変化、あるいは別なもっと複雑な調節機構によるものではないかと推測している。 国立衛生研究所(NIH)のDepartment of Engineering Servicesは最近、数多くの形状の動物飼育室に維持されている静圧アイソレータに伴うミクロ環境条件とマクロ環境条件をモデル実験した綿密な試験の結果を公表した。この試験は経験的測定、風洞検査、および、とりわけ、コンピュータ流体力学(CFD)(39)を用いた。CFDは空気、水、あるいは他のあらゆるガスや液体の運動を予測するのに用いられる進歩した3次元数理モデルである。この試験は実験動物施設およびケージの評価にCFDをはじめて用いた代表であり、正確なCFD計算に必要な境界条件を測定し実験的に確認した。NIHによる試験は、動物室の形状、とくに給気ディフューザの位置とタイプおよび排気調節弁の位置、ならびにそれらが静圧アイソレータケージのミクロ環境に及ぼす影響に関してなされた多くの歴史的仮説はすでに認められている教義に反する可能性があることを指摘した。動物のためのミクロ環境を改善するとされる動物室の形状は職員のためのマクロ環境を改善するために用いられるものとは明らかに異なる可能性がある。たとえば、高レベルの排気は熱換気効率を改善するけれども、静圧アイソレータにおけるケージ内換気を減らし、ミクロ環境のNH3濃度とCO2濃度を増加させる結果となる。 静圧アイソレータは、その欠点にもかかわらず、今日の動物実験において重要な役割を演じている。静圧アイソレータはケージレベルでの封じ込めが望ましい試験にとってとくに有用である(40)。例としては、、病原体、有害化合物および放射性核種などの有害物質のin vivo投与がある。静圧アイソレータはさらに封じ込めレベルを高めるために陰圧フローのMADU、BSC、あるいは化学的有毒ガス排気フードのような二次エンクロージャー内に置くことができる。有害物質の封じ込めに用いられるときには、できれば静圧アイソレータは、用いるハザードによって、適切なBSCあるいは有毒ガス排気フードの中で開け、汚染した動物やケージ内容物を取り扱わなければならない。ケージ内換気、およびその結果として、ミクロ環境条件は、静圧アイソレータをMADL内に収容したときに改善される。それは、おそらくフィルタートップ上に気流が増加するためであろう(17)。 静圧アイソレータケージのユーザはこの装置の限界を知り、その限界を処理する方法を知っておかなければならない。ミクロ環境の悪い空気の質、とりわけケージ内NH3濃度の蓄積を処理するには4つの原則的な方法がある。十分な頻度でケージを交換する(17);望ましい性能特徴を有する接触床敷を使用する(35);マクロ環境のRHを減らす(12);そして空気中の水分含量を変化させずに、マクロ環境の温度を上げる(39)。ケージはケージ内NH3濃度が蓄積する前に交換しなければならない。図2は21℃、44% RHの動物室に収容し、オートクレーブした松カンナクズを入れた静圧アイソレータからの典型的なNH3発生曲線を示す。この例において、ケージを週2回交換すれば、マウスは高いNH3濃度の影響を受けることがない。なぜならば、NH3濃度は4日目まで増加を始めないからである。NH3発生曲線における有意な差が異なる接触床敷を用いたときに観察された(35)。2つの主要な差が観察される:すなわちNH3が初めて検出される日、および曲線の傾斜である。たとえば、ミクロ環境のNH3濃度は一般に、ほとんどの系統のマウスを望ましい性質を持つ接触床敷(たとえばコーンコブ)上に収容したとき、the Guideに規定されているマクロ環境の温度およびRHの値における7日の交換サイクルの間には検出されない。これとは対照的に、あまり望ましくない床敷(たとえば松カンナクズ)を入れたとき、同じ系統と数のマウスを収容した同一のマクロ環境条件下に置かれたケージ中ではNH3濃度が顕著に高い。図3に示されるように、望ましい性質を持つ床敷を選ぶことによってNH3発生曲線を右にシフトさせることができる。これによってNH3検出日が遅れ、同時に曲線の傾斜が弱くなるので、単位時間あたりのNH3の発生が少なくなる。同じ床敷を用いながらマクロ環境のRHを減らしても同様の結果が得られる。マクロ環境のRH、床敷依存性の閾値が存在する。その閾値上ではNH3発生が床敷間で差がない(41)。マクロ環境のRHが > 70%のとき、NH3発生曲線はコーンコブ床敷と松カンナクズ床敷との間で差がない。マクロ環境のRHを60%に下げると、コーンコブ床敷のNH3発生曲線の傾斜は7日間にわたりゼロの近くまで減少したが、松カンナクズ床敷のNH3発生曲線は無変化のままであった。マクロ環境のRHをさらに < 50%に下げると、松カンナクズ床敷のNH3発生曲線の傾斜はゼロ近くまで低下し、60% RHにおけるコーンコブ床敷の曲線と似てくる。このような差の原因となる床敷の特異的性質はわかっていない:しかし、単に吸収性に関連しているわけではない(35)。異なる床敷材の望ましい性質の利点をとるために床敷タイプをミックスすることができる。
NH3発生、床敷、およびマクロ環境のRHの間の関係を理解することが、とくに実験を行い解釈するときには、必須である。Choiら(16)は、43% RHと39% RHのマクロ環境においてコーンコブ床敷を入れた静圧アイソレータケージと換気アイソレータケージにおけるケージ内RHとNH3濃度に及ぼす収容密度の影響を評価した。著者らは換気アイソレータケージにおいて交換後32日にNH3を検出しなかった。静圧アイソレータではNH3濃度は10日目で < 4 ppmであった。両ケージとも成マウスを4匹まで収容した。この試験が、異なる接触床敷を用い、より高いマクロ環境RHを用いて行われていたならば、この試験の結果はおそらく、かなり異なったものになっていただろうし、おそらく異なった解釈が生まれたであろう。Reebら(42)はマクロ環境の換気回数が、ミクロ環境のNH3濃度とRHに及ぼす影響をしらべた;しかし、マクロ環境のRHは一定に維持されず、換気回数を上げると50% RHから22% RHに減少した。この試験の結論には疑義が出されている(43)。 これらの例は、ケージと床敷の交換頻度は結果に基づいて決めなければならないことを示している。ミクロ環境のNH3濃度が多くのげっ歯類コロニーにおいてこれを決めるのに用いなければならないただ1つの重要な基準である。それゆえに、著者は、げっ歯類を飼育している施設は、ケージ内のNH3濃度を定期的に測定することを推奨する。幸い、、このような測定は簡単で費用がかからない。Matherson-Kitagawa Toxic Gas Detection System (Matherson Gas Products, Secaucus, NJ)あるいはDraeger Multi-Gas Detector System (Draegerwerk AG, Lubeck, FRG)のような濃度測定装置は手動操作のガスサンプリング・ポンプと検出管を用いている。NH3濃度を測定するためにフィルタートップを取り外すと、ケージ内濃度に顕著な影響を及ぼすので、サンプリングするケージはポートのあるものに改造して、ケージ内NH3濃度をルーチンに測定できるようにしなければならない。
動物室と連結した換気装置を静圧アイソレータケージと一緒に用いることによって拡散、対流、および輻射によって受動的にミクロ環境の換気が得られる。数多くの試験によって、この方法は、エネルギーおよび運転上集約的であり、有効でないことが示されている(8-12)。対照的に、ミクロ環境をケージに連結した装置で直接換気し、ミクロ環境の空気の質を大幅に高めることができる。VCSの使用によって得られるミクロ環境の空気の質の改善はこの装置の人気が大幅に高まっている基本的理由の1つである。 げっ歯類のケージを直接換気しようとした最初の試みは1960年代にJackson Laboratory (Jax) によってなされた(44, 45)。Dr. Lesの指揮の下に、JaxはVCSの開発を、ケージ内換気を改善するためばかりでなく、収容能力を高めるために開始した。Jaxは1970年代終わりにThoren Caging Systems, Inc.との協同開発を始める前にいくつかのプロトタイプを開発した。Jax用に開発された最初の装置は1980年代初めに改良され最初の市販VCSとなった。その後に開発された装置は、現在市販されているが、Reemayィを入れたフィルタートップを採用した。Reemayィを入れたフィルタートップは初期のモデルには存在しなかった。 静圧アイソレータケージにおけるミクロ環境の空気の質が悪いことと、ケージ内の動物に対して悪影響があることに拍車をかけられて、VCSは1990年代初めまでに広く人気を集めた。このめざましい成長は、ユニークなトランスジェニック動物と“ノックアウト”動物の生産と使用が増えた結果として多くの研究所でマウスの数が飛躍的に延びたことも理由とすることができよう。選択可能な市販装置の数が年々拡大した。既存のメーカがそのモデルとオプションを改良し種類を拡大しつづけてきた。あいにく、装置が多様化するにつれて、ユーザがどの装置がもっとも自らのニーズに合致していて、必要な融通性を得られるかを決定することが、とくに比較データが少ないこと、換気回数はどれだけが適切かのコンセンサスがないこと、および装置の性能を評価する標準テクニックがないことに照らして、極めて困難になった。 換気アイソレータケージ・システムによって静圧装置よりも数多くの利点が得られる。換気アイソレータケージ・システムがミクロ環境の空気の質を顕著に改善することが明確に報告されている(16, 19, 34, 46-50)。ケージ内のNH3濃度(図2)およびCO2は、同じ系統で同じバイオマスのマウスを収容し同じマクロ環境下に置いたとき、静圧ケージに比べて換気ケージのほうがかなり低い。さらに、NH3が初めて検出される日が換気ケージで遅くなる。ケージ内の空気の質が改善されるばかりでなく、同じマクロ環境に置かれた静圧アイソレータケージで観察されるミクロ環境の空気の質のバラツキがVCSにおいて少なくなるか、あるいはまったくなくなる(19)。換気ケージではNH3の発生が少なくなるので、マクロ環境の空気の質が動物飼育室やケージ洗浄で作業している職員にとって改善される。 多くの施設において、収容しているマウスの系統、それらの実験用途、収容密度、および所内位置関係によって、換気ケージの交換は週1回あるいはそれ以上に延ばすことができる(5)。週2回頻繁に交換する必要のある静圧アイソレータケージとは対照的に、週1回のケージ交換はかなりの省力化を意味する。ケージ交換における省力に加えて、ケージの消毒に費やされる時間および用いられる床敷の量も減少する。ケージ部品の寿命、とくにオートクレーブする必要のあるポリカーボネートで作られているケージ部品の寿命は、永くなる。これらの要因すべては、施設およびげっ歯類の数によっては、運転コストの節減につながるであろう。 VCSによって得られるもう1つの大きな利点は収容密度がかなり増加することである。同じ設置面積を占めている静圧ケージ・システム(SCS)と比較するとき、VCSはどの装置と比較するかによって2倍以上のマウスを収容することができる。<0.76 x 1.83 mの設置面積を占める1台のVCSは29.2 x 18.4 cmのげっ歯類用弁当箱型ケージを140個も収容することができる。明らかなことは、VCSは以前SCSを用いていた施設において収容能力を大幅に高めるために使用することができる。代わりに、VCSの使用によって研究所は新しい施設の大きさを大幅に減らすことができ、あるいは既存のげっ歯類収容スペースを他の用途に転換することができる。このような状況下において、コスト節減は、建設費の節減のみならず、かなりの額の運転コストの減少において、大きなものがある。動物施設へHVACを供給するのに必要なユーティリティ・コストは合衆国においては$88.3-141.3/m3/min/yrと推定される。15回換気/hの動物飼育室をもつ2787 總m2の動物施設がVCSを用いることによって929總m2減らすことができれば、エネルギー節約だけで$50,000-80,000/yrと推定される。さらに運転コストの節減、建設コストの節減および労働力の節減まで考慮すれば、SCSと比べてVCSの購入に支払われる割り増し価格は速やかに回収できる。 VCSによって特定の状況下で応用できる別の利点が得られる。VCSは換気の不適切なげっ歯類飼育室あるいは施設において既存のHVAC装置の交換または増設のより費用のかかるオプションの代わりに使用することができる。VCSはケージを直接そしてより効率的に換気する。ミクロ環境とマクロ環境の性能基準はSCSを使用するときに必要とするよりもかなり少ない給気によって達成される。ミクロ環境の空気容量はマクロ環境のそれよりも小さいので、ミクロ環境は、マクロ環境を換気するのに要するよりも少ない給気で高率に換気することができる。 VCSは給気を建物のHVAC装置から直接供給するか、あるいは排気を建物のHVAC装置へ直接排出するかによって、いろいろな方法を用いて施設と統合することができる。たとえば、VCSからの排気を施設の排気装置へ直接排出する場合には、動物室へ供給される給気容量は多くの条件下でかなり減らすことができる。この設置方法は、マクロ環境の換気回数が少なくてすみ、エネルギーコストが減少する。これらのコンセプトは詳しくまとめられている(53)。 VCSはまた、使用する装置の特異性によっては、ケージ内に収容されている動物に防御バリアを追加する(54, 55)。HEPAフィルター浄化給気でケージを加圧している装置は、ケージ内の動物に汚染からの防御レベルを追加する。VCSの有効性は実験的に確かめられている(55)。マウス肝炎ウイルス(MHV)に対して血清反応陰性の、免疫的に未経験のマウスを、MHVに感染していてウイルスを放出しているマウスを入れたカバーのないケージの存在下で、カバーのない弁当箱型ケージ、静圧アイソレータケージ、および換気アイソレータケージに収容した。ケージはオートクレーブをし、クラスIIのBSC内で取り扱った。カバーのない弁当型ケージおよび静圧アイソレータケージ内に収容した免疫的に未経験のマウスの、それぞれ100% および20%がMHVに対して抗体が陽転したが、陽圧に加圧した換気ケージ内に収容したマウスは1匹も陽転しなかった。 多くのVCSは排気を動物室内へ放出する前にケージ排気をHEPAフィルターで浄化するか、あるいは、そのかわりに建物のHVAC装置へ排気を直接排泄しているので、マクロ環境内のアレルギー性粒子の濃度が減少する。マクロ環境の粒子濃度が1つのVCSで評価された(56)。降下粒子プレートを用いて測定した粒子は、装置を陽圧モードと陰圧モードで運転したときオープントップケージと比較してそれぞれ99%と94%減少した。比較は静圧アイソレータケージと行われたのではなく、1つのVCSタイプだけが評価されたことを記しておくことが重要である。他の装置を使えばより高濃度の粒子が動物室内へ遊離される結果となるであろう。いくつかの一般的なVCSはケージ排気がケージから出た後で捕捉しようとしてケージを加圧して運転されている。ケージ排気のマクロ環境への漏出がトレーサーガスを用いてこれらの装置で測定されている(57)。 VCSの利点は明白であるけれども、これらの装置を選択し使用するに際して考慮しなければならない重要な点がいくつかある。ユーザは使用しようとする装置の運転原理を十分に理解しなければならない。特定の装置ごとに各ケージへ供給される空気の導入方法と量に関して差がある。VCSのための理想的なケージ内換気回数はわかっておらず、収容する動物種、系統あるいは血統、ケージ内密度、および用いる床敷など数多くの要因に依存しているようである。ある状況における理想的な換気回数は別の状況においては不十分であったり過剰であったりする。ケージ内換気回数を選択するために用いられる基準は性能基準に基づくべきである。著者はVCSにおける換気回数は、ケージ交換する前に、ミクロ環境のNH3濃度とCO2濃度がそれぞれ25および5,000 ppm以下であり、温度とRHがthe Guide(18)に規定されている限界内に入るように設定することを推奨する。さらに、ケージ内の動物が遭遇するだろうと思われる位置におけるケージ内気流速度が< 50 linear feet/min (lfpm)でなければならない。この速度はヒトの環境における静止空気と考えられており、多くの動物種で生理学的影響が起きないとされている(59, 59)。Jaxで行われた最近の試験結果によると、成雄の代わりに繁殖トリオおよび仔マウスを収容し、同じ交換頻度とケージ内NH3濃度が維持されるとすれば、ケージ内換気回数を60から100回/時に増やさなければならないと報告されている(51)。VCSのための換気回数に関する正確な情報を得ることは極めて困難である。換気回数を測定するためのテクノロジーは室や建物を評価するために設計されている;それはげっ歯類のケージの大きさのエンクロージャーを評価するためには設計されていない。げっ歯類のケージの容積は<0.028 m3あるいはその給気または排気流量は< 0.5 CFMである(0.014 m3/分)。いくつかのグループは換気ケージ内換気回数を評価するためにトレーサーガス(SF1)減衰を用いてきた(51, 56, 57)。それは他のテクニックよりも正確であるが、ケージ容積が小さいために精度には限界がある(57)。 過剰なケージ内換気は、とくに空気がケージのレベルで供給されるときには、とくに新生仔およびヘアレス・ミュータントの場合に、さむけと脱水を起こす。動物が暴露されている空気の速度は熱と水分が動物から奪われる速さに影響する。20淸において60 lfpmで動いている空気は約7淸の冷却効果を持つ(14)。新生仔、ヘアレス・ミュータントあるいは1匹だけの動物を収容するとき、あるいは接触床敷が用いられていないかあるいは動物が巣作りできないタイプのものであるとき、ミクロ環境の温度を上げてやる必要があるかもしれない。特定のげっ歯類、血統、あるいは系統を交配するときには、フェロモン希釈も問題になるかもしれない。Huerkampら(60)は換気ケージと自動給水装置とを併用すると仔マウスの斃死率が高くなるというマイナスの相乗効果を報告している。さらに、VCS内で育てられた仔マウスはSCS内で育てられた仔マウスよりも小さく、ケージ内換気の変化によるものであると報告されている。 メーカ、装置のタイプ、そして装置の稼働年数によってもVCSの換気回数にかなりの違いがある。市販の3種の装置を比較したところ、ケージ内換気回数が88%も異なることが示唆された(57)。50 lfpmを越える速度が評価した3つのVCSのうちの2つで認められ、1つの装置では速度が100 lfpmまで近づいていた(57)。最近まで、メーカはVCSモデルを新しくするごとにケージ内換気回数を増加させる傾向にあった;しかし、ユーザから害作用が報告されてきたため多くのメーカはこの戦略を再検討している。幸い、換気回数は、多くのVCSで排気および/または給気ファンのスピードあるいはダンパーを調節することによって、調節することができる。 VCSを選択し使用する場合に、熱負荷、騒音発生、電力条件および停電、振動、および消毒なども検討しなければならない。VCSによってユーザは収容密度を2倍まで上げることができるので、動物が発生する熱負荷はかなりの大きさになる。給・排気ブロワーによって発生する熱負荷を動物の熱負荷に加えると、とくにぎりぎりの温度制御が行われている動物室では、HVAC装置の冷却能を越えることがある。この問題はVCS排気を建物のHVAC装置へ直接排出することによって解決できる場合が多い。なぜならば熱負荷の多くは排気の中に含まれているからである。 VCSブロワーは一般に110-V電流を使用している。装置のデザインによっては、排気ブロワーと給気ブロワーは相互に連結しており、1つのコンセントだけあればよい場合と、各ブロワー(装備されていれば給気と排気ブロワー)にそれぞれのコンセントが必要な場合がある。複数のVCSラックをインストールする場合には、必要な電源コンセントの数が設置数を越えてしまうことがある。VCSを発電器から供給される回路上におくことは賢明である。なぜならば、多くのVCSのデザインは停電の場合に受動換気をできるようになっていないからである。実際、装置の中には、フィルターのないソリッド・トップを用いているものがあり、ガスケットおよび/またはクリップで下のケージにしっかりと固定されている。排気ブロワーと給気ブロワーの運転が機能的に相互連結していて、万一、停電の場合には、他が自動的に停止するようになっていることを確認しておくことが装置を選ぶさいに必須である。たとえば、VCSによって動物が保護されていることが絶対的であるとするならば、給気ブロワーが停止した場合には排気ブロワーがシャットダウンしなければならない。この機能が使われていない場合は、給気ブロワーが停止するか、あるいはその出力が低下すると、ケージは陰圧となる。多くの装置には警報ランプ、圧力計、および可聴および/またはボルト警報がついていて、施設スタッフによる能動的あるいは受動的モニタリングができる必要がある。 排気ブロワーおよび/または給気ブロワーが発生する騒音は装置のタイプおよび飼育室あたりのVCSユニットの数によっては問題である。騒音は2つの視点から取り上げられなければならない:飼育室内で作業している職員に及ぼすマクロ環境の騒音の影響:およびケージ内の動物に及ぼすミクロ環境の騒音の影響。動物の行動および騒音に及ぼす騒音のインパクトが報告されている(61, 62)。げっ歯類の聴覚範囲はヒトのそれと、部分的にオーバラップしているにすぎない;その範囲はヒトが聴くことができない超音波周波数まで広がっている。VCSが発生する騒音に関する発表データは数少ない(19, 56)。31.5と16,000 Hzの間の周波数のミクロ環境およびマクロ環境の騒音が市販VCSで調べられた(19)。3つの装置すべてから動物室のバックグランドよりも有意に高い室内騒音が発生した。1つのユニットからは評価した他の2つのユニット(74 dB)よりも多くの騒音(80 dB)が発生した。dBスケールは対数的であることを考えれば、この差は明かである。ミクロ環境の騒音は、評価した3つの装置において、マクロ環境の騒音および高い周波数で発生する騒音と比べて、低い周波数で高いことがわかった。これらの所見がげっ歯類に及ぼす影響は明かでない。げっ歯類は高周波数に対するよりも低周波数に対して高い耐容性をもっていると推定される(64)。しかし、著者は超音波周波数を評価しなかった。超音波周波数は1つのVCSの他の試験では検出されなかった(56)。等量の騒音を発生するユニットを1つの動物室にさらに追加したときのdBレベルの増加を測定するために対数式が用いられる。2台目で3 dB、3台目で1.8 dB、4代目で1.2 dBそしてさらに追加する1台ごとに< 1 dBずつ増加した(65)。それゆえに、それぞれ80 dBを発生する4ニットを入れた動物室では、ACGIH設定の8-H TWAの85 dB(20)を越えるレベルの86 dBとなる。 連続する低レベルの振動の生理学的影響は著者の知るかぎり調べられていない。ラックに直接取り付けられたブロワーをもつVCSはケージレベルで振動を発生しやすい。行動学者は環境刺激によってタイミングキューが生まれることを心配しているけれども、VCSは連続して運転される;それゆえに、、この点に関しては影響を及ぼしそうにない。それにもかかわらず、装置のメーカはケージ内振動を減らすか無くするために以下のステップのいくつかあるはすべてを採用してきた;ラック搭載ブロワー・ハウジングをゴムおよび/またはスプリングを積んだマウント上に置く;複数のブロワーを飼育ラックとは離れた1つのラックおよび/または棚の上に収納する;ラックの空気配分装置とブロワーとの間をフレキシブル・プラスチック・ホースで連結;および/または給気を供給し排気を排泄するために施設のHVAC装置を使用する。 VCSには多くの空気配分装置があるので、標準的な棚式ラックに比べて消毒がかなり困難である。概して、ブロワー、棚、および/またはアクセス・パネルはVCSをラックワッシャーに入れる前に取り外すし、および/または開けなければならない。ケージラック上のすべてのプレナムおよびダクトへのアクセスはあらゆる装置で可能というわけではない。手で大量に洗浄することが必要となることが多い;空気配分装置はワッシャーのスプレーが届きにくいのでラックワッシャーで適切に消毒することができない。VCSラックの消毒頻度に関してはコンセンサスがない。著者の施設では、動物の健康状態に変化がなく、あるいは消毒頻度を増やす特殊条件がない限り、ラックは、少なくとも6カ月ごとに分解して消毒している。プレフィルターは、VCS上に供給されていれば、特定の装置および使用する床敷によって、もっと頻繁に交換あるいは洗浄する必要がある。ブロワー・ユニットはファン・モーターおよびHEPAフィルターなどの特殊部品は液体を用いて消毒することができないので、分解して洗浄しなければならない。これらの部品の消毒が必要な場合には、ガス滅菌が用いられる。大きな労働力を必要とするけれども、VCSをユニット全体を袋に包むか、あるいは動物室を隔離してパラホルムアルデヒドのようなガス滅菌剤を用いて滅菌することによって、その場で除染することができる。 VCSを消毒することが難しいこと、および装置によっては濾過されていないケージの排気が遊離するおそれがあるために、感染動物あるいは有害物質に暴露した動物を収容する前にその使用にかなりの配慮を払う必要がある。濾過されていないケージ排気がマクロ環境へ遊離することは、ある種の装置について報告されており、有害物質を用いるときの新たな問題となっている(57)。有害物質の試験中に動物を収容するためにVCSを用いることは、ケージ排気を先ず適当なフィルターを通し、および/または排気を直接建物のHVAC装置へ放出せずにマクロ環境へ排出しない装置に限定すべきである。VCSの中にはケージ内を陰圧にして運転でき、そのためにこのような試験に好まれているものがある。安全をHEPAフィルターに依存している装置は、有資格技術者によってフィルターの完全な状態と機能を、年1回以上、あるいはBSCに推奨されている条件よりも頻繁に、保証されなければならない(66)。重要なことは、すべてのVCSがHEPAフィルターを検査するためにアクセスしやすく組み立てられているとは限らないことである。 7つのメーカが合衆国市場向けにVCSを製造している。これらの装置間には運転およびデザインにかなりの差がある。私はVCSをその運転上のデザインに基づいて2つの基本クラスに分類している:ケージ内給気/周辺捕捉装置;およびケージ内給気/ケージ内排気装置。後者はさらに、給気あるいは排気が、ケージに入るあるいは出る前にケージのレベルでフィルターを通過するかどうかによって、直接、間接あるいは組み合わせの3サブタイプに分けられる。図4A-Fはいろいろな装置を図示したものである。 ケージ内給気/周辺捕捉装置はAllentown Caging Equipment Co., Inc., Allentown, NJ (ACE)およびLab Products, Inc., Seaford, DE (LP)によって製造されている。これらの装置、すなわちMicro-Flo/Micro-Vent (ACE)およびMicroisolator VCLェ (LP)は類似の原理を用いて運転される。HEPAフィルター浄化空気がケージのレベルで直接供給される結果、加圧されている。ケージ排気が原則としてフィルタートップ/弁当型ケージのインターフェースから逃げ、そのインターフェース(ACEおよびLP)およびフィルター(LP)において3面U型チャネル(ACE)あるいはキャノピー(LP)によって捕捉される。これらの装置は陽圧モードでのみ運転できる。両装置は給気ブロワーと排気ブロワーが必要であり、これらはケージラックまたは壁にインストールできる。代わりに、施設の中央HVAC装置によって給気したり排気したりすることもできる。両装置の独立した実験的評価が発表されている(16, 19, 34, 67, 60)。 ケージ内給気/ケージ内排気(直接)装置はAlternative Design, Siloam Springs, AR (AD); Tecniplast S.a.r.l., Bugugiatte (VA), Italy (TP);およびLenderking Caging Products, Millersville, MD (LK)によって製造されている。これらの装置すなわち、Gentle-Air (AD), Tecniplast IVCェ (TP)、およびCCM IsoVentェ (LK)は空気をアイソレータケージのフタ(AD, TPおよびLK)あるいはケージボトム(TP)へ直接供給し、そして空気をフタ(ADおよびTP)からあるいはケージの下のプレナムから(LK)直接排気する。ADの装置は給気と排気を行うのに1つのブロワーを用いている。ブロワーは装置が陽圧モードあるいは陰圧モードのいずれで運転するために購入されるかによって、ラックのボトムまたはトップのいずれかに搭載される。給気と排気はスプリング付きドアを通ってソリッドフタを貫通しているバルブを通ってケージに流れ込んだり流れ出たりする。TPはその装置のいくつかのバージョンを製造している。そのVent-Plus IVCェ装置は空気を直接ケージに供給し、空気を直接フタから排気する;Sealsafe IVCェ装置は空気をフィルタートップへ直接供給し排気する。フィルタートップにはケージ内で空気の方向を決めるバッフルが付いている。TPの装置はブロワーのスピードを調節することによって給気と排気の量を電子的に変化させることによって陽圧モードか陰圧モードのいずれかによって運転することができる。 LKのケージは3つのセクションに分けられる。すなわち、ソリッドトップと給餌器によって形成される給気プレナム、穴あき床のある動物を収容するケージ本体、および排泄物が落ち排気が吸引されるケージの下の廃棄物区画。代わりに、ソリッドボトムのケージあるいはフィルタートップを穴あきケージあるいはソリッドフタに置き換えることができる。ブロワーはラック上に直接(AD、TPおよびLK)、離れたラック上に(TPおよびLK)、あるいは壁に(AD、TPおよびLK)搭載することができる。著者の知るところでは、これらの装置の独立した試験は報告されていない。3装置(AD、TPおよびLK)のすべてはユニットブロワーの代わりに施設のHVACから運転することができる。 ケージ内給気/ケージ内排気(間接)装置はThoren Caging Systems, Inc., Hazelton, PA (TCS)およびBioZone, Margate, Kent, UK (BZ)によって製造されている。それらの装置、すなわちMaxi-Miser IIェ (TCS)およびVentiRackェ (BZ)は、陽圧および陰圧のプレナムまたはダクトの真下に存在するケージのフタの中にあるフィルターを通して空気を供給し排気を除去する。給気はプレナムまたはダクトからフィルターを通ってケージ内に拡散するが、、排気については逆のことが起きる。両装置はダンパーの位置を手動で変更するか(TCS)あるいはブロワースピードおよび/または給気および排気ダクトに位置するコントロールバルブを横切って生じる圧力減少を調節することによって給気および排気の量を電子的に変更することによって(BZ)陽圧モードあるいは陰圧モードのいずれかによって運転することができる。ブロワーはラック上に直接(TCSおよびBZ)、独立したスレッド上にあるラックの下に直接(TCSおよびBZ)、離れたラック上に(TCS)、あるいは壁上に(TCSおよびBZ)搭載することができる。代わりに、施設のHVACを給気、排気あるいは両方のために使用することができる(TCS)。両装置(TCSおよびBZ)は排気を直接、施設のHVAC装置へ導くようにインストールすることができる。TCS装置は数人の研究者によって独立して実験的に評価されている(19, 34, 51, 56, 57)。 ケージ内給気/ケージ内排気(組み合わせ)。TCSによってそのアイソレータトップにオプションのバルブが提供されている。それはケージをラック上に置いたときに開き、、ケージを取り外したときに閉まる。バルブは、通常給気上に置かれているが、フタの中のフィルターを迂回し、ケージ内の陽圧を維持している空気の直接流入を提供している。ACEは最近、bio-containment unit (BCU)(生物学的封じ込めユニット)換気ケージ・システムを発売した。BCUはHEPAフィルター浄化空気を供給される弁当型ケージ、および排気用のフィルターが入り周辺ガスケットの付いたソリッド・ロックのフタからできている。TCSの装置は実験的に評価されている(56)。 VCSを選択するさいには多くの要因を考慮しなければならない。これらの装置は高価なので、適切な装置を選ぶことが必須である。考慮すべき事のいくつかはこの総説内で考察してきたが、その中には、装置の使用目的は何か;動物の保護と職員の保護とどちらが重要か;装置の運転を陽圧から陰圧へ、あるいはその逆に変更したいという要望があるか;寿命が限られているケージ部品の交換コストなどのコストはどれだけか;修理点検のしやすさと修理点検体制;消毒はできるか、しやすいか;ミクロ環境をコントロールできるか;動物を観察しやすいか;フィルター(HEPA)機能を検査できるか;換気方法と換気回数;施設との統合の方法;および重量と可動性がある。あいにく、換気回数、ミクロ環境のコントロール、および封じ込め能力を比較することが難しい。その理由は、精選した装置の公表文献は限られており、標準化されていないテクニックを用いているからである。BSCの機能基準を確認するために開発され公表されているような客観的基準をVCSを評価するために開発する必要がある。VCSのメーカ、エンジニア、安全専門家、およびVCSユーザは協力して、この基準問題に取り組まなければならない。 施設管理者、獣医師、および科学者は、以前にも増して、各種のケージ・システムから実験用げっ歯類を収容するための装置を選ぶことができることが、この総説から明かとなった。購入するためにケージ・システムを選択する責任を持つ個人はもとより装置のユーザも彼らが使用する装置の機能と限界を理解しておくことが大切である。 |